肺癌的研究越来越深入,我们的武器也越来越多。
靶向药物正是其中的重要代表之一。
所谓靶向药物,就是针对特定靶点开发的针对抑制剂。
这些特定靶点,往往是驱动正常肺细胞演进为癌细胞的关键基因。
所以,靶向治疗的原理就在于,通过药物针对性抑制这些驱动基因的活性,从而阻止甚至逆转肺癌的发生发展,提高肺癌治疗效果。
在我看来,如果将治疗肺癌比作一场国家战斗,那每个驱动基因,就是我们要攻克的一座座城池。
所谓攻城拔寨,就是点亮一个个驱动基因。
这里,有耳熟能详的EGFR驱动基因、也有归为钻石突变的ALK驱动基因。
这一期,郑医生想聊聊一个相对冷门的驱动基因,即BRAF。
BRAF驱动基因
2002年的<自然(Nature)>刊载的一项研究上,指出BRAF异常激活驱动人类恶性肿瘤发生发展。
BRAF激活,主要来自BRAF V600E突变。
因此,本文讨论的BRAF激活,主要也指的这种突变类型。
BRAF作为驱动基因的身份自此被坐实。
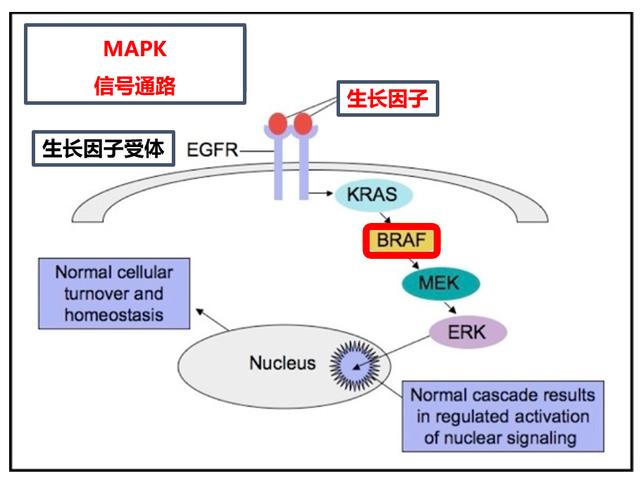
简单来说,BRAF是MAPK信号通路的一员。
MAPK信号通路主要负责细胞增殖能力的调控,很多明星分子,比如EGFR、KRAS都是这个信号通路上的一员。
在正常情况下,生长因子(Growth Factor,GF)作用于细胞表面的表皮生长因子受体(epidermal growth factor receptor, EGFR),从而激活下游信号通路(包括BRAF),最终激活细胞增殖。
但是,在BRAF异常激活状态下,这条信号通路就会异常活化,细胞增殖变得不再需要外来刺激(生长因子作用)而可以独立、持续存在。
最终演变为不受机体控制的增殖行为,就是肿瘤。
开发针对BRAF的靶向抑制药就是为了逆转这种现象。
BRAF激活对肺癌的影响

那BRAF激活对肺癌的生物学行为到底影响如何呢?
2011年,<临床肿瘤学杂志(Journal of Clinical Oncology)>上刊载的一项研究,探讨了这个问题。
研究者回顾性分析了意大利比萨大学医疗中心,从1996到2006年10年医疗记录,从中得到1370名接受彻底手术治疗的非小细胞肺癌患者。
包括739例肺腺癌和307例肺鳞癌。
最终发现37例合并BRAF异常激活。
其中36例出现在肺腺癌患者(97.3%),21例是V600E突变(58.3%)。
分析发现,BRAF异常激活肺腺癌患者,更容易表现为微乳头式的侵袭性生长模式。
在预后分析方面,合并BRAF异常激活的肺癌患者,复发和死亡风险均显著升高。
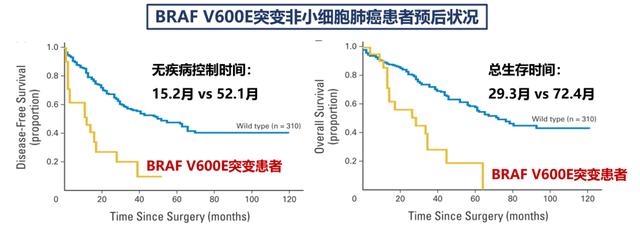
更恐怖的是,这部分患者,采用单纯化疗效果不佳。
2016年,<柳叶刀(Lancet)>上刊载的一项研究,纳入晚期合并BRAF突变非小细胞肺癌患者。
发现,针对这部分患者:
一线化疗,客观缓解率只有23%,无进展生存时间7.9月;
二线化疗,客观缓解率只有9%,无进展生存时间3.1月。
现在肺癌的一线疗法,客观缓解率往往达到60%-70%。
BRAF靶向药
达拉非尼是由诺华公司开发的,针对BRAF的靶向抑制剂。
研究发现,药是没毛病,但是单用效果就是不好。
2014年在欧洲肿瘤学年会(europeon society of medical oncology, ESMO)上发表的一项研究,探讨了采用达拉非尼单药治疗BRAF突变晚期非小细胞肺癌的治疗效果(BRF113928)。
最终,纳入84名合并BRAF V600E突变的转移性非小细胞肺癌患者。
在单药控制下,客观缓解率只有32%。
而即便在实现缓解的人群中,药效也不持久,短期耐药现象时常发生,而BRAF所在的MAPK信号通路的再激活是其主要耐药机制。
据此,有专家提出假说:
既然MAPK信号通路确实在肺癌发生发展中发挥着举足轻重的作用,而BRAF又是其中关键的一环,但单用BRAF抑制剂效果又不太好,那就只能说明一个问题。
就是,单靠BRAF抑制剂,抑制不住MAPK信号通路。
那既然这样,我们能不能尝把这个信号通路中的两个关键靶点都同时抑制看看?
于是,就出现了现在的双靶治疗:
即在应用针对BRAF的抑制剂达拉非尼的基础上,加用了针对MEK的抑制剂曲美替尼。

据此理念设计的前瞻性临床研究,于2017年发表于国际肿瘤期刊天花板<柳叶刀肿瘤学(Lancet Oncology)>上,彰显了主流学界对其成果的肯定。
在这个研究中,作者纳入36名既往未接受治疗的合并BRAF V600E突变的转移性非小细胞肺癌患者,采用达拉非尼联合曲美替尼的方式进行治疗。
最终,36名入组患者中,有23名实现了肿瘤退缩≥30%,客观缓解率达到63.9%,平均无进展生存时间达到14.6月,总生存时间24.6月。
而随着时间的推移,双靶治疗积累的真实世界数据甚至要更好。
2022年在美国肿瘤学年会(american society of clinical oncology, ASCO)上爆出的一项研究,彰显了双靶治疗的威力。
在这个研究中,作者纳入163名合并BRAF V600E的患者,采用双靶治疗。
其中,一线治疗患者44例,后线治疗患者119例。
所谓一线治疗,就是患者在首次诊断以后就给的治疗方式。
此时患者体质最好,对治疗的反应也最好,因此数据往往最优。
而后线治疗,指的是患者在首次/多次治疗失败后采用的治疗方式。
此时患者体质已大不如前,治疗的反应也差,因此数据往往也差于一线。
最终,一线治疗组客观缓解率高达82.9%,平均无进展生存时间达到18.2月,总生存时间24.1月;
二线治疗组客观缓解率也有73.8%,平均无进展生存时间达到10.4月,总生存时间19.7月。
大家如果对这组数据没有概念,我可以换个角度进行解释:
现在针对EGFR突变的治疗方法已经非常成熟,但即便采用最先进的三代靶向药奥希替尼,去治疗初治晚期EGFR突变非小细胞肺癌(FLAURA研究),其平均无进展生存时间也只有18.9月。
双靶治疗的实力和疗效已然得到完美证实。
截至目前,针对合并BRAF V600E突变的转移性非小细胞肺癌,双靶治疗已经成为各大主流治疗指南的推荐疗法。
写在最后
肿瘤发生发展是一个庞杂的系统过程,包括多个环节,涉及多个驱动基因的异常激活。
从这个角度来说,单一的靶向药物干预治疗下的肿瘤,就算有效果,也很容易死灰复燃。
针对BRAF V600E的疗法,在刚开始的单一靶点治疗,就是这样。
单药达拉非尼作用下的客观缓解率只有32%,也就比单纯化疗高9%。
一线化疗,客观缓解率23%,平均无进展生存时间7.5月。
但是,一旦把BRAF下游的MEK抑制剂曲美替尼也拉进来,效果一下子就飙起来了。
双靶治疗下,客观缓解率达到惊人的64%,平均无进展生存时间达到14.6月。
2022年爆出的更大宗的真实世界研究中,客观缓解率甚至达到82.9%,平均无进展生存时间18.2月。
但是,这么一个成熟的、早在早在2017年就发表于柳叶刀肿瘤学的成熟疗法,为什么今天我要特地拿出来分享?
因为我从这个疗法的开发过程中,看到了肺癌治疗的无限可能和美好未来。
没错,我们现在采用单一的靶向治疗已经能够很好地克服包括EGFR、ALK等驱动基因的问题。
但这些可能只是靶向治疗蛋糕上,最浅的一层。
冰山一角而已。
要想更好地挖掘深部宝藏,我们需要开发更多的优秀的靶向药,为将来更好的多靶治疗创造可能。
在2022年的ASCO上,有这么一项研究令世人瞩目,即针对KRAS G12C的靶向药Adagrasib (MRTX849)的II期临床研究(KRYSTAL-1研究)。
众所周知,KRAS突变是非常常见的一个驱动基因,存在于14%的非小细胞肺癌患者中,基本持平EGFR,远高于BRAF。
换句话说,如果这个驱动基因也被良好攻克,那将极大地补足目前靶向治疗领域的空白,对肺癌的治疗影响将非常深远。
最终,这个研究纳入后线治疗且合并KRAS G12C突变的转移性非小细胞肺癌患者,以Adagrasib单药进行治疗,实现了51%的客观缓解率、并实现了6.5月的平均无进展生存时间。
足以证明未来可期。
所以,为什么我认为肺癌的治疗,充满无限可能?
背后的底气,正是来自这些不断开发且疗效优异的靶向药。
我很喜欢亚洲舞王,尼古拉斯.赵四的一句话:
在这个世界上,没有什么事儿是一顿烧烤不能解决的;如果有,那就两顿。
这个放在肺癌治疗也是一样的。
在这个世界上,没有什么肺癌是单个靶向药不能解决的;如果有,那就两个。
所以,如果你问我,我们该怎么做才能彻底治愈肺癌?
很简单,一枪打不死的,打两枪就可以了。